文/林志鴻
●電池 化學能→電能 電解 電能→化學能
電池和電解是兩種正逆反應的現象,孩子們學習這部分時很容易混淆,所以利用圖表來辨識兩者的異同是很好的學習技巧。電池是利用化學變化來產生電能;電解是利用電能來產生化學變化,首先,我們可以先列出這兩種反應的主要差異。
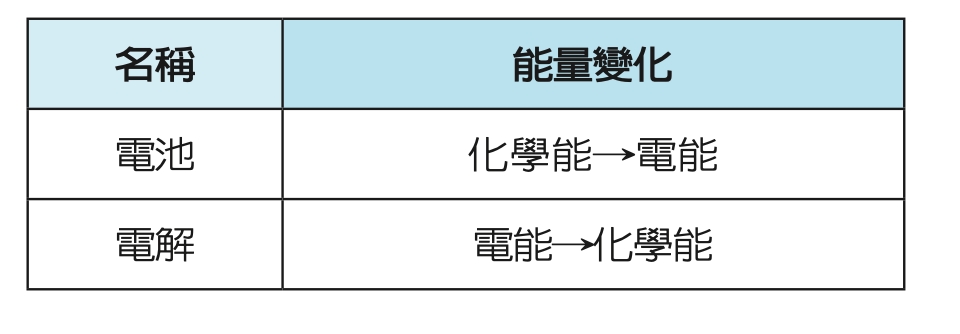
若以內外電路來分,電池屬於內電路;電解屬於外電路。電流的流向是由電池的正極經外電路到電池負極,再由電池負極經內電路回到電池正極,形成封閉迴路。
電子流與電流方向相反。用文字來描述很像繞口令一樣,不好理解,可以畫一個簡單的電路來幫助記憶,如左圖。用圖來記就容易多了。
只要記得電流由電池的正極開始,繞一圈形成迴路;電子流和電流方向相反即可。內電路的流向是正往正、負往負。
●鋅銅電池圖解 太複雜 簡化成金屬片 好講解
國中範圍考最多的電池是伏打電池,尤其是鋅銅電池。第一次看到鋅銅電池的圖解(如右圖),對孩子而言,真的是複雜到難以令人招架。
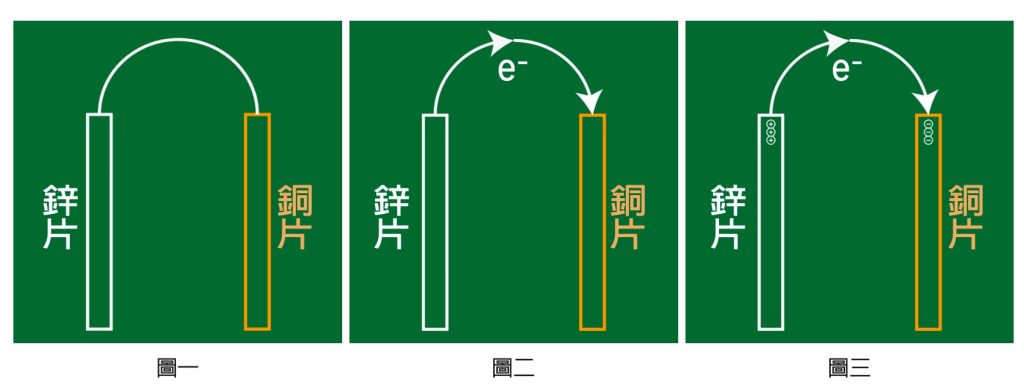
面對這種圖,最好的方法是由繁入簡,先從最簡單的開始,一開始要從鋅和銅兩塊金屬片開始,通常我會在黑板上先畫出兩塊長方塊當作兩塊金屬片,最好是用白色和橘色的粉筆來畫,白色的當作鋅、橘色的當作銅,再用一條電線連接起來,如圖一。
活性大的金屬比較容易失去電子,所以鋅片和銅片以導線連接在一起,電子就會從鋅(活性大)跑到銅(活性小)。只要簡單的把電子的方向畫出來即可,如圖二。
第一個電子很容易從鋅跑到銅,但第二個電子要離開鋅時,因為鋅會帶一個正電,所以會吸住電子,同時銅因帶有一個負電,所以電子要靠近銅片時,會被排斥,會增加電子移動的困難。所以第三顆電子比第二顆電子更難移動,依此類推,最後電子無法移動,電流就消失了(圖三)。
●電荷累積 電子移動困難 如何解決 用電解質溶液
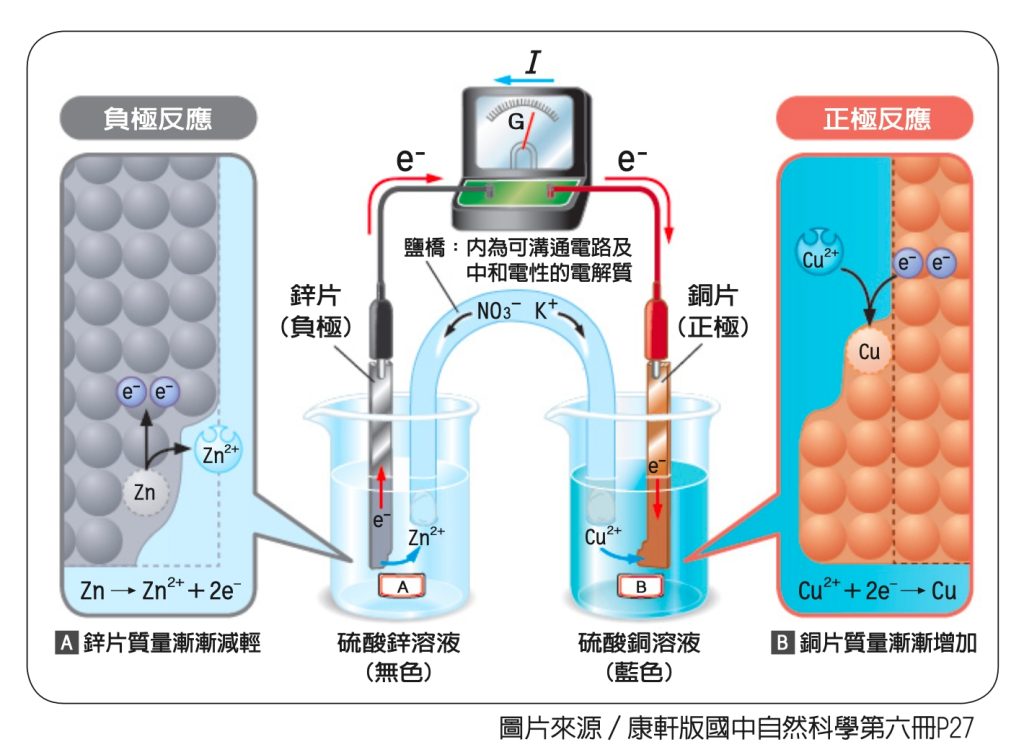
造成電子移動困難的原因是兩片金屬上電荷累積的現象,如果可以立即解決電荷累積,就可以讓電子源源不絕的從鋅片移動到銅片。通常會利用電解質溶液的正、負離子來解決電荷累積的問題:準備硫酸銅和硫酸鋅兩杯電解質溶液,將銅片和鋅片放入這兩杯溶液中,如圖四。
鋅原子把兩個電子丟到銅片那裡,鋅原子變成鋅離子溶到硫酸鋅溶液裡,使得硫酸鋅溶液的正電增加(Zn→Zn2++2e-);兩個電子到了銅片那裡,會吸收硫酸銅溶液裡的銅離子過來,銅離子吸收了兩個電子就會變成銅原子,黏在銅片上,溶液中的銅離子減少(Cu2++2e-→Cu),使得溶液帶負電。乍看之下,好像解決了鋅片和銅片上的電荷累積,但這只是障眼法,把原來電子轉移形成的問題,變成兩杯溶液的正負離子不平衡。
最後需要鹽橋來解決才行。鹽橋裡面裝有易解離的鹽類溶液,我們拿硝酸鉀溶液裝入U型管裡,兩端開口用棉花塞緊後,倒插進兩杯溶液中,如圖五。
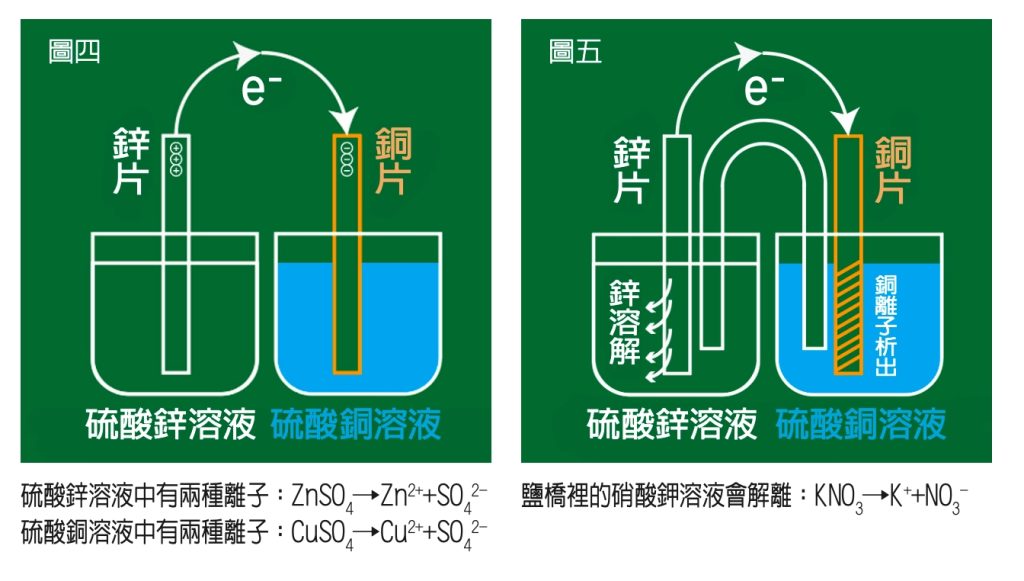
鹽橋裡的硝酸鉀溶液會解離:KNO3→K++NO3-,K+移向帶負電的硫酸銅溶液,中和掉硫酸銅因銅離子減少而帶的負電;NO3-移向帶正電的硫酸鋅溶液,中和掉硫酸鋅因鋅離子增加而帶的正電。
如此就可以徹底解決電荷累積的問題,讓電子可以源源不絕從鋅片移動到銅片上。其實電流不會源源不絕,鹽橋裡的K+和NO3-耗盡,電流也就停止流動了。
整個鋅銅電池的講解告一段落,孩子們聽完一定會覺得很混亂,如果沒有加以整理歸納,學生很容易迷失在概念的迷宮裡繞不出來。其實我們需要這兩張圖即可。
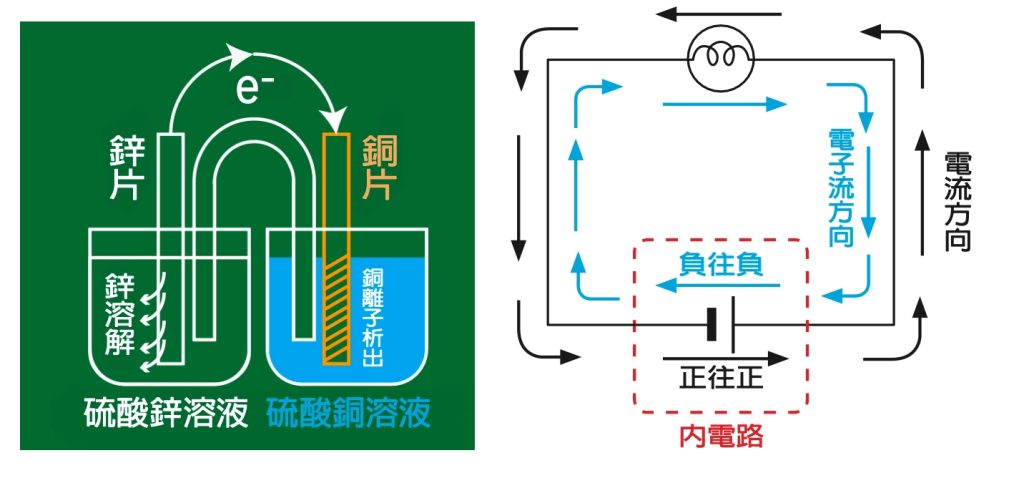
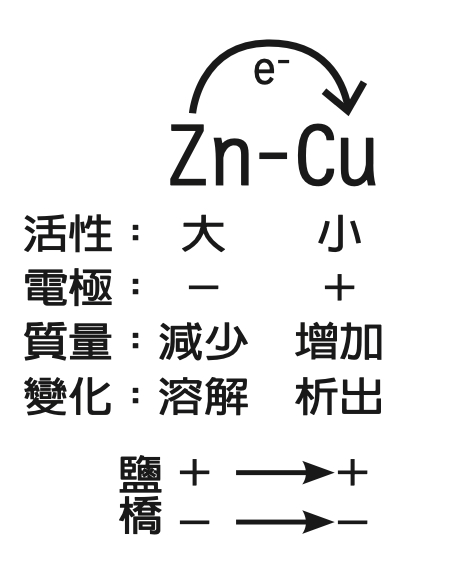
首先,鋅活性大於銅,所以電子從鋅片出發,到達銅片。鋅為電池的負極、銅為電池的正極。比較右上圖的電路圖藍色的箭頭方向。
其次,鋅溶解使得鋅片的質量減少,恰好配合負極的負號,提醒質量會減少;銅離子析出,使得銅片的質量增加,恰好配合正極的正號,質量增加。
參考右上圖電池內部的電流及電子流方向,正電流向正極,負電流向負極,可以記成正往正、負往負:鹽橋裡的正離子(K+)向正極(銅片)移動、負離子(NO3-)向負極(鋅片)移動。鋅銅電池的複雜概念就可以精簡為一張圖。
●電池通電 靠金屬活性 電解通電 靠正負相吸
電池的起源是因為金屬活性不同,而使得丟電子的能力有差別,活性大的金屬把電子丟給活性小的金屬;但電解是靠正負電相吸的原理,來使得電解質的正負離子向兩極移動,發生化學變化來傳遞電子,形成迴路。
電流的化學效應(簡稱為電解)和電池的反應剛好相反過來,我們用電解硫酸銅溶液來說明如何用圖解來幫助理解和記憶。
電解的觀念最早出現在阿瑞尼士的解離說,他認為電解質溶入水中,會被水給拆成正、負離子,正負離子在水中自由移動、平均分布。水溶液中除硫酸銅解離(CuSO4→Cu2++SO42-)之外,還有水(H2O→H++OH-)的解離,硫酸銅解離出來的銅離子(Cu2+)和硫酸根(SO42-)的量比水解離出來的氫離子(H+)和氫氧根(OH-)還要多很多,當然最多的還是水分子(H2O)。如果我們對電解質溶液通以直流電,正離子會受到負極電子的吸引,游到負極去獲得電子;負離子會游向正極,到那裡釋放電子。
利用石墨棒為電極,來電解硫酸銅溶液,我們先畫出一個簡單的圖示,如圖六。
先從電子的流向開始:電子由電池的負極出發,先到右邊負極的石墨棒上,吸引溶液中帶正電的銅離子靠過來反應:Cu2++2e-→Cu。
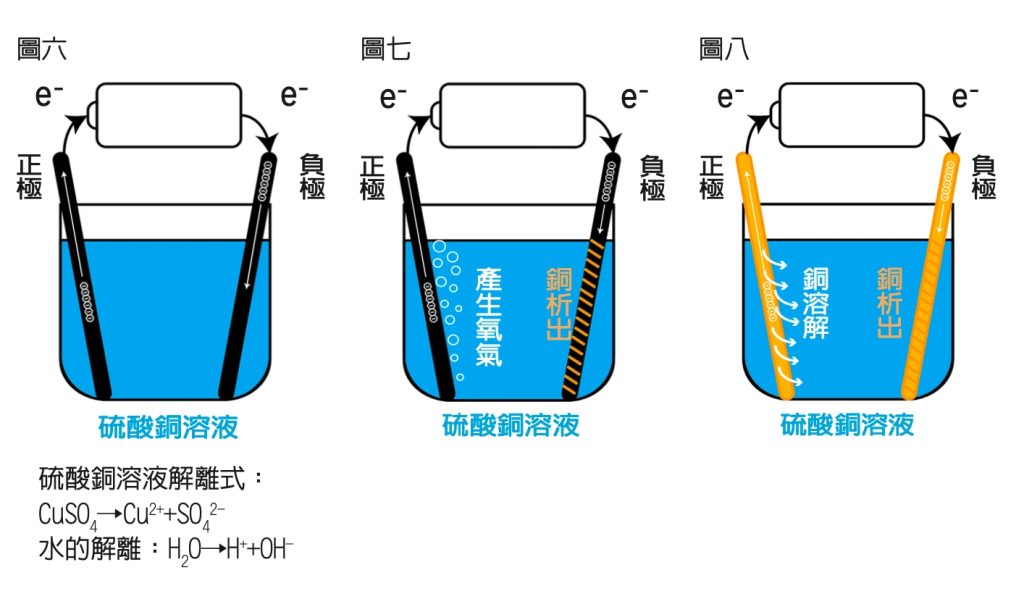
左邊的正極會發生化學變化而放出電子,回到電池的正極。直覺來說,應該SO42-發生反應:SO42-→SO2+O2+2e-,但SO42-很穩定,要發生反應,需要很高的電壓,而真正發生反應的是水被電解了:2H2O→4H++O2+4e-,因為水電解需要的電壓比電解硫酸根的電壓小很多,綜合以上的現象,可以畫簡圖解如圖七。
如果把石墨棒換成銅片,負極還是銅析出,但正極會變成銅溶解,銅溶解比電解水更容易發生,可畫簡圖解如圖八來幫助記憶。所以兩極會發生什麼反應,要實際進行實驗才能知道。
電解應該用圖來記,注意電子流動的方向,正、負電相吸來思考正負離子的移動及變化,就可以迎刃而解。千萬不可死背死記!
●作者為高雄小港國中自然科老師,喜歡在課堂上穿插各種小故事,啟發孩子對科學的興趣。
原文出自《好讀周報》764期